Атом
Атом (бурун-грек ἄτομος «чардынмас[1], кестинмес[2]») — бүдүмелдиң дыка бичии хемчээлдиг болгаш деңзилиг кезээ, химиктиг элементиниң химиктиг шынарларының эдилекчизи болуп чоруур эң хензиг кезээ[1][3].

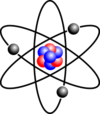
Атомнар ядро болгаш электроннардан тургустунар. Атомнуң ядрозу протоннар болгаш нейтроннардан тургустунган. Ядрода нейтроннарның саны аңгы-аңгы боор: тиктен он-он чедир. Бир эвес электроннарның саны ядрода протоннар саны-биле деңнежи бээр болза, атом ниитизи-биле нейтралдыг болур. Ындыг экс боор болза, кадар азы казыыр октаглыг (зарядтыг) болур, ынчан ону ион деп адаар[1][3][4].
Ядрозу атомнуң деңзизиниң 99,9 ажыг хуузун тургузуп турар болгаш күштүг удур-дедир харылзаа-биле туттунган кадар октаглыг протоннардан болгаш октаг чок нейтроннардан тургустунган болур. Атомнарны ядрозунда протоннарның болгаш нейтроннарның саны-биле бөлүктеп турар: протоннарның Z саны Менделеевтиң химиктиг элементилерниң периодтуг системазында дугаарынга дүгжүп турар боор болгаш бир-ле химиктиг дүдүмелге хамаарылгазын көргүзүп турар боор, а нейтроннарның N саны ол-ла элементиниң тодаргай изотовунга хамаарылгазын көргүзер.

Понятиениң тургустунганының төөгүзү
эдерМатерияның эң бичии чардынмас кезээ деп атом дугайында билиглерни бурунгу индий база бурунгу грек философтар илередип бижээннер. XVII болгаш XVIII чүс чылдарда химиктер ол бодалды экспериментилер дузазы-биле бадыткаан. Химиктиг методтар дузазы-биле кезек бүдүмелдерни улаштыр чарып болбазын көргүскеннер. Ынчалза-даа XIX чүс чылдың төнчүзүнде — XX чүс чылдың эгезинде физиктер субатомнуг кезектерни болгаш атомнуң тургузуглуун ажытканнар. Ынчан атом боду база кезектерлиг деп билдинген, ынчангаш бүдүмелдиң эң бичии чардынмас кезээ деп статузун чидирген.
Атомнуң тургузуу
эдерСубатомнуг кезектер
эдерАтом деп сөс эгеки утказында бодундан бичии кезектерге чардынмас кезекти илередип турган-даа болза, амгы үениң эртеминде ол бодундан бичии кезектерден тургустунган: электроннар, протоннар, нейтроннар.
Электрон атомнуң тугустунган кезектериниң эң чииги, казыыр октаглыг, эң бичии хемчээлдиг[5].
Протоннар кадар октаглыг болгаш электрондан 1836 катап аар деңзилиг. Нейтроннар электрилиг октаг чок болгаш электрондан 1839 катап аар деңзилиг[6].
При этом масса ядра меньше суммы масс составляющих его протонов и нейтронов из-за явления дефекта массы. Нейтроны и протоны имеют сравнимый размер, около 2,5⋅10−15 м, хотя размеры этих частиц определены плохо[7].
Элементерлиг кезектерниң стандарттыг моделинде нейтроннар-даа, протоннар-даа кварктардан тургустунган. Лептоннар-биле кварктар материяның кол тургустунган кезектери болуп турар. Кварктар бот-боттарының аразында глюоннар дамчып болуп турар күштүг ядролуг харылзаа-биле тутчуп турар[8][9].
Атомда электроннар
эдерАтомда электроннар ядрога чоокшуладыр тыртылып турар, электроннар аразында кулоннуң харылзаазы база бар боор. Ол-ла күштер электроннарны ядрону долгандыр потенциалдыг барьерге тудуп тура. Электрон ядронуң тыртыжын ажып эртер дээр болза, аңаа даштындан келген энергия негеттинер. Электрон ядрога чоок болган тудум, оон адырлып алырда аңаа хөй энергия херек.
Атомнуң шынарлары
эдерДеңзизи
эдерАтомнуң деңзизин колдуу протоннарның болгаш нейтроннарның деңзизи тургузуп турар болганда, оларның түңүн деңзилиг сан деп адаар. Атомнуң деңзизин дальтоннар-биле (Да) илередир. Дальтонну углерод-12-ниң нейтралдыг атомунуң деңзизиниң 1⁄12 кезээ-биле тодарадыр. Атомнуң деңзизи деңзилиг санның дальтонга көвүдеткенинге дең болур[10].
Хемчээли
эдерАтомнар тодаргай ылгалып турар даштыкы кызыгаар чок болур. Ынчангаш оларның хемчээлин химиктиг харылзаа тудуп турар дөмей атомнарның ядроларының аразын хемчээп тодарадыр, ону ковалентилиг радиус дээр. Азы атомнуң бодунуң электроннуг картының эң доктаамал кезээниң хемчээли-биле тодарадыр, ону атомнуң радиузу деп адаар[11]. Атомнарны бөдүүн оптиктиг микроскоп таварыштыр көөрү болдунмас.
Атомнуң хензиин дараазында чижектер-биле бараалгадып болур. Кижиниң чажының дүгү углеродтуң атомундан бир сая катап чоон боор. Сугнуң бир дамдызында 2 секстиллион (2⋅1021) кислородтуң атомнары бар, ында водородтуң саны ийи катап хөй. 0,2 грамм бир карат алмаз 10 секстиллион углеродтуң атомнарында тургустунган болур. Бир эвес яблокту Черниң хемчээлинге чедир улгаттырыпкан болза, атомнарның хемчээли яблоктуң бодунуң хемчээли хире боор[12].
Харьковтуң физика-техниктиг институдунуң эртемденнери эртмениң төөгүзүнде атомнуң бир дугаар чуруктарын бараалгаткан. Ол чуруктарны электроннуг микроскоп ажыглап кылганнар[13].
Демдеглелдер
эдер- ↑ 1,0 1,1 1,2 Большой энциклопедический словарь. Физика / Гл. ред. А. М. Прохоров. — М.: Большая Российская энциклопедия, 1998. — ISBN 5-85270-306-0.
- ↑ Большой иллюстрированный словарь иностранных слов / Ред. Е. А. Гришина. — АСТ; Астрель; Русские словари. — ISBN 5-17-008793-4.
- ↑ 3,0 3,1 Ельяшевич М. А. Атом // Большая Советская Энциклопедия. 3-е изд. / гл. ред. А. М. Прохоров. — М.: Советская энциклопедия, 1970. — Т. 2. Ангола — Барзас. — С. 389—394.
- ↑ Химический энциклопедический словарь / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1983.
- ↑ Demtröder, 2002.
- ↑ Woan, 2000.
- ↑ MacGregor, 1992.
- ↑ The Particle Adventure. Particle Data Group. Lawrence Berkeley Laboratory (2002). Хынаан 3 Бир айның 2009. Архивтээн 2011 Сес айның 21.
- ↑ Elementary Particles. University of Oregon (2006-04-18). Хынаан 3 Бир айның 2007. Архивтээн 2011 Сес айның 21.
- ↑ G. Audi, A. H. Wapstra, C. Thibault. The Ame2003 atomic mass evaluation (II) (und) // Nuclear Physics. — 2003. — Т. A729. — С. 337—676. Архивировано из первоисточника 16 Тос айның 2008. Archived 2008-09-16 at the Wayback Machine
- ↑ R. D. Shannon. Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides (en) // Acta Crystallographica, Section A : journal. — International Union of Crystallography, 1976. — Vol. 32. — P. 751. — Майык:DOI. Архивировано из первоисточника 30 Тос айның 2007.
- ↑ Feynman, 1995.
- ↑ First Detailed Photos of Atoms. Inside Science News Service (2009-09-14). Хынаан 24 Алды айның 2014. Архивтээн 2014 Алды айның 24.
Литература
эдер- Бете Г., Солпитер Э. Квантовая механика атомов с одним и двумя электронами. — М.: Физматгиз, 1960.
- Бейдер Р. Атомы в молекулах. Квантовая теория. М.: Мир, 2001. — 532 c.
- Веселов М. Г., Лабзовский Л. Н. Теория атома: Строение электронных оболочек. — М.: Наука, 1986. Архивная копия от 31 июля 2013 на Wayback Machine
- Зоммерфельд А. Строение атома и спектры. Том 1 — М.: ГИТТЛ, 1956.
- Зоммерфельд А. Строение атома и спектры. Том 2 — М.: ГИТТЛ, 1956.
- Шпольский Э. В. Атомная физика. Том 2. Основы квантовой механики и строение электронной оболочки атома 4-е изд. — М.: Наука, 1974.
- Анги дылда
- Michael F. L’Annunziata. Handbook of Radioactivity Analysis. — 2003. — ISBN 0-12-436603-1.
- H. F. Beyer, V. P. Shevelko. Introduction to the Physics of Highly Charged Ions. — CRC Press, 2003. — ISBN 0-75-030481-2.
- Gregory R. Choppin, Jan-Olov Liljenzin, Jan Rydberg. Radiochemistry and Nuclear Chemistry. — Elsevier, 2001. — ISBN 0-75-067463-6.
- J. Dalton. A New System of Chemical Philosophy, Part 1. — London and Manchester: S. Russell, 1808.
- Wolfgang Demtröder. Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics. — 1st ed. — Springer, 2002. — ISBN 3-540-20631-0.
- Richard Feynman. Six Easy Pieces. — The Penguin Group, 1995. — ISBN 978-0-140-27666-4.
- Grant R. Fowles. Introduction to Modern Optics. — Courier Dover Publications, 1989. — ISBN 0-48-665957-7.
- Mrinalkanti Gangopadhyaya. Indian Atomism: History and Sources. — Atlantic Highlands, New Jersey: Humanities Press, 1981. — ISBN 0-391-02177-X.
- David L. Goodstein. States of Matter. — Courier Dover Publications, 2002. — ISBN 0-48-649506-X.
- Edward Robert Harrison. Masks of the Universe: Changing Ideas on the Nature of the Cosmos. — Cambridge University Press, 2003. — ISBN 0-52-177351-2.
- Tatjana Jevremovic. Nuclear Principles in Engineering. — Springer, 2005. — ISBN 0-38-723284-2.
- James Lequeux. The Interstellar Medium. — Springer, 2005. — ISBN 3-540-21326-0.
- Z.-P. Liang, E. M. Haacke. Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging / J. G. Webster. — John Wiley & Sons, 1999. — Т. 2. — P. 412—26. — ISBN 0-47-113946-7.
- Malcolm H. MacGregor. The Enigmatic Electron. — Oxford University Press, 1992. — ISBN 0-19-521833-7.
- Oliver Manuel. Origin of Elements in the Solar System: Implications of Post-1957 Observations. — Springer, 2001. — ISBN 0-30-646562-0.
- Robert M. Mazo. Brownian Motion: Fluctuations, Dynamics, and Applications. — Oxford University Press, 2002. — ISBN 0-19-851567-7.
- Ian Mills, Tomislav Cvitaš, Klaus Homann, Nikola Kallay, Kozo Kuchitsu. Quantities, Units and Symbols in Physical Chemistry. — 2nd ed. — Oxford: International Union of Pure and Applied Chemistry, Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications, 1993. — ISBN 0-632-03583-8.
- Richard Myers. The Basics of Chemistry. — Greenwood Press, 2003. — ISBN 0-31-331664-3.
- Michael J. Padilla, Ioannis Miaoulis, Martha Cyr. Prentice Hall Science Explorer: Chemical Building Blocks. — Upper Saddle River, New Jersey USA: Prentice-Hall, 2002. — ISBN 0-13-054091-9.
- Linus Pauling. The Nature of the Chemical Bond. — Cornell University Press, 1960. — ISBN 0-80-140333-2.
- Jeremy I. Pfeffer, Shlomo Nir. Modern Physics: An Introductory Text. — Imperial College Press, 2000. — ISBN 1-860-94250-4.
- Leonid Ivanovich Ponomarev. The Quantum Dice. — CRC Press, 1993. — ISBN 0-75-030251-8.
- J. Kenneth Shultis, Richard E. Faw. Fundamentals of Nuclear Science and Engineering. — CRC Press, 2002. — ISBN 0-82-470834-2.
- Robert Siegfried. From Elements to Atoms: A History of Chemical Composition. — DIANE, 2002. — ISBN 0-87-169924-9.
- Alan D. Sills. Earth Science the Easy Way. — Barron’s Educational Series, 2003. — ISBN 0-76-412146-4.
- Boris M. Smirnov. Physics of Atoms and Ions. — Springer, 2003. — ISBN 0-38-795550-X.
- Dick Teresi. Lost Discoveries: The Ancient Roots of Modern Science. — Simon & Schuster, 2003. — P. 213—214. — ISBN 0-74-324379-X.
- Graham Woan. The Cambridge Handbook of Physics. — Cambridge University Press, 2000. — ISBN 0-52-157507-9.
- Charles Adolphe Wurtz. The Atomic Theory. — New York: D. Appleton and company, 1881.
- Marco Zaider, Harald H. Rossi. Radiation Science for Physicians and Public Health Workers. — Springer, 2001. — ISBN 0-30-646403-9.
- Steven S. Zumdahl. Introductory Chemistry: A Foundation. — 5th ed. — Houghton Mifflin, 2002. — ISBN 0-618-34342-3.
Шөлүглер
эдер- Атом в Физической энциклопедии
- Atomic Size. Clackamas Community College. Хынаан 9 Бир айның 2007. Архивтээн 2011 Сес айның 21.
- How Atoms Work. How Stuff Works. Хынаан 9 Бир айның 2007. Архивтээн 2011 Сес айның 21.
- The atom. Science aid+. Хынаан 9 Бир айның 2007. Архивтээн 2011 Сес айның 21.
- Atoms and Atomic Structure. Би-би-си (2006-01-03). Хынаан 11 Бир айның 2007. Архивтээн 2011 Сес айның 21.
- Physics 2000. University of Colorado (2006-01-03). Хынаан 11 Бир айның 2008. Архивтээн 2011 Сес айның 21.
- Почему электрон не падает на ядро? Archived 2020-12-08 at the Wayback Machine Научный журнал ARI Archived 2021-12-03 at the Wayback Machine
- Украинские ученые впервые сфотографировали атом (2009-09-16).
- Ученые изолировали, захватили и сфотографировали атом Рубидия 85. Хынаан 1 Он айның 2010. Архивтээн 2012 Февраль 2.
- Строение атома Archived 2023-05-14 at the Wayback Machine
- Строение атома (учебный фильм)
- Спектры атомов. Хынаан 10 Он айның 2010. Архивтээн 2011 Сес айның 21.
- Структура атомов, учебный фильм. Хынаан 10 Он айның 2010. Архивтээн 2011 Сес айның 21.